泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2016-11-07 转至微博:
|
医药网11月2日讯 2016年是中国优先审评元年。CFDA 2016年初出台药品优先审评审批政策,其初衷是解决药品注册申请积压中,某些临床急需、市场短缺的药品注册申请排队的问题。
获批的速度对于药企的重要性不言而喻。对于来说,优先审评制度减少了新药排队等候的时间,提高了新药研发的效率,加快新药上市;对于行业来说,优先审评制度制度使有限的审评资源向创新和临床急需品种倾斜,行业品种青黄不接的局面会逐步得到缓解。
10月28日,CFDA发布了第九批29个拟纳入优先审评的药品受理号清单。目前申请优先审评的具体名单尚未正式公布,而已披露的优先审评品种主要是首仿药和临床急需药物。
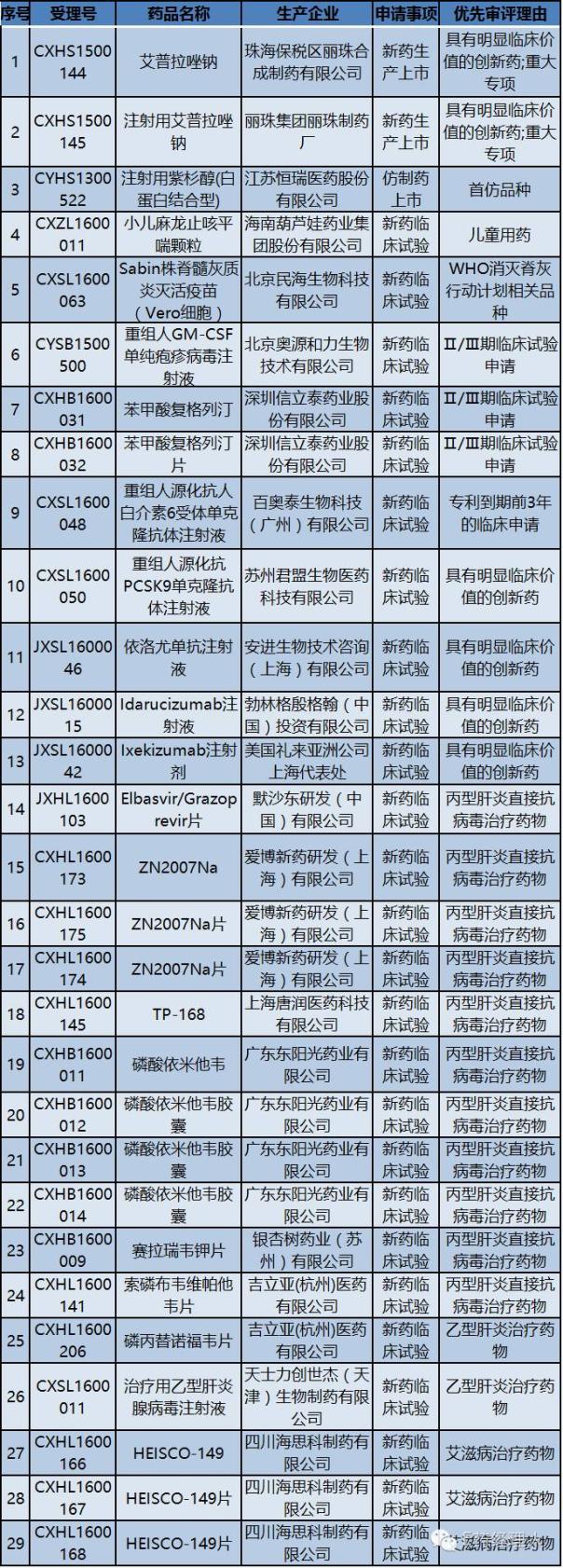 第九批29个受理号,加之前八批96个,2016年以来CFDA已经给予125个药品优先审评权(没有排除有异议品种),其中申请上市的受理号数量有70个,11个属于外资药企,59个属于本土药企。
以下是10月28日CFDA公布的最新一批(第九批)拟纳入优先审评的品种名单:
E药经理人梳理了这九批70个申请上市的受理号目前的最新审评进展,这些获得优先特权的产品真实的审评状态是怎样的?他们真的审评速度更快吗?
数据显示,在70个上市申请受理号中,已经有31个结束了临床审评。例如,恒瑞的盐酸右美托咪定鼻喷剂5月2日开始药理毒理审评,6月22日药理毒理审评结束;6月12日被纳入优先审评清单后,8月26日临床开始审评,9月1日临床结束审评,临床审评只用了5个工作日。
其他受理号的审评速度也明显加快,如万特制药的左乙拉西坦,以及成都天台山制药和四川鼎诺泰宸科技的左乙拉西坦注射液2016年9月1日开始临床审评,9月26日结束审评,历时不到1月。
优先审评药品上市申请最新审评进展
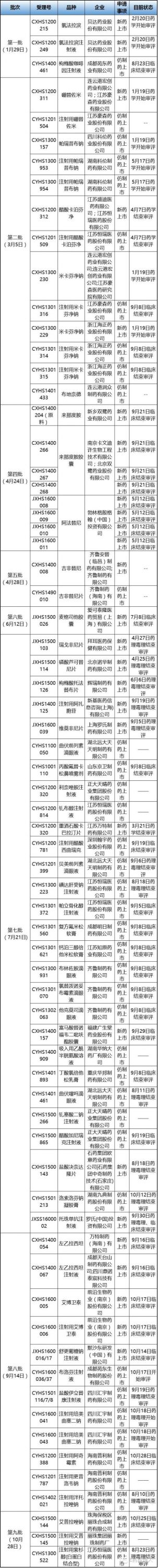 进度来源:医药魔方
其中两个值得重点关注的品种分别是,双鹭药业的来那度胺,4月份进入优先审评,9月21日临床结束审评;广生堂的替诺福韦,7月份进入优先审评流程,9月29日临床结束审评。
可以供参考的是FDA对于美国药品上市提供的四种快捷方式:快速通道、突破性疗法通道、优先审评、加速审评,分别针对药品研发上市过程中的各种环节做相应的辅助、优先、合法“插队”。而目前CFDA所推行的优先审评政策相较而言,范围比较宽泛,是四种方式的一个选择性集合,进一步细化、科学化、系统化,仍值得期待。
关键词:
|