泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2017-12-27 转至微博:
|
医药网12月25日讯 2017年12月22日,CDE发布关于公开征求《已上市化学仿制药(注射剂)一致性评价技术要求》意见的通知,自口服制剂开展一致性评价后,注射剂也开始走上一致性评价的道路。
一、没有像289目录那样限定首批开展注射剂的范围
本次征求意见稿并没有提及所针对的注射剂的通用名范围,除了提到氯化钠注射液、葡萄糖注射液、葡萄糖氯化钠注射液、注射用水等原则上不纳入一致性评价范围,这意味着几乎所有化学药仿制药注射剂要开展一致性评价。
已上市注射剂不具有完整和充分的安全性、有效性数据的,开展再评价。原研药品已经停止生产,又不在美国橙皮书标识为RS的产品,预计都要开展再评价。
二、没有限定窗口期
289目录的产品要求2018年年底完成一致性评价。注射剂再评价此前是预计5-10年完成的,一致性评价属于再评价范围内,由此可以推测化学药注射剂的窗口期会到2023年-2028年。
三、稳定性研究技术建议其中一批为近效期样品
一致性评价前期的药学研究预计要6个月,注射剂的保质期一般要两年,这意味项目申报最快要2年,加上参比制剂的购买等,预计注射剂一致性评价要耗费3年。
再参考2016年初启动化学药口服制剂一致性评价,2017年年底才把相关文件发完,加上国家局发文的速度,国内最快也要4年才能拿到一致性评价标签。相较之下,有条件的企业还不如美国拿个ANDA双报国内,弯道超车。
对于近效期超过2年的产品,没事的,2023年才是最后限期呢,大家慢慢做。
此外,还要求仿制药的稳定性应不低于参比制剂,这又提高了行业的门槛。
四、不建议使用低硼硅玻璃和钠钙玻璃
根据征求意见稿,注射剂使用的直接接触药品的包装材料和容器应符合总局颁布的包材标准。不建议使用低硼硅玻璃和钠钙玻璃。首先受冲击的是低硼硅玻璃和钠钙玻璃的生产企业,如低硼硅玻璃安瓿生产企业成都平原尼普洛药业包装有限公司、山东力诺特种玻璃股份有限公司等。
其次就是使用低硼硅玻璃和钠钙玻璃的药品生产企业,又要需要变更包装材料和容器了。根据咸达数据V3.5分析补充申请备案情况公示数据库发现,至少有220个通用名注射剂目前使用低硼硅玻璃,其中203个是化学药。至少有73个通用名注射剂目前使用钠钙玻璃,其中72个是化学药注射剂。
以利巴韦林注射液为例,吉林敖东药业集团延吉股份有限公司、吉林百年汉克制药有限公司、济南利民制药有限责任公司和宜昌人福药业有限责任公司都是使用低硼硅玻璃安瓿。
五、特殊注射剂要做BE/临床试验
特殊注射剂(如脂质体、静脉乳、微球、混悬型注射剂等)一致性评价还需参照FDA、EMA发布的特殊制剂相关技术要求,并且采用商业批量的样品进行BE试验和/或临床试验。加上临床试验时间,相关特殊注射剂预计还要多花2年才能完成一致性评价。
六、过量灌装要和原研一致
根据征求意见稿,如原研产品存在过量灌装,仿制药的过量灌装宜与原研产品保持一致,如不一致需提供合理性论证。根据FDA,仿制药的过量灌装应该采取适当抽样的研究。
但是2015年版药典要求,灌装标示装量为不大于50ml的注射剂时,应按下表适当增加装量。除另有规定外,多剂量包装的注射剂,每一容量的装置一般不得超过10次注射量。
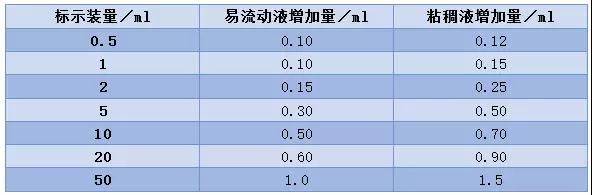 预计大多数国内厂家都没有研究过注射液原研药的过量灌装情况,更多是根据药典灌装标示。那么万一征求意见稿和药典一旦发生冲突,是按药典规定呢,还是一致性评价规定呢?
七、改规格、改剂型、改盐基注射剂
改规格方面,在适应症相同的情况下,不得改变注射剂原批准的用法用量或适用人群,其规格一般不得小于单次最小给药剂量,也不得大于单次最大给药剂量。由于单次最小给药剂量往往是成年人的剂量,小于单次最小给药剂量的考虑往往与儿科药相关,个别小于单次最小给药剂量未必在美国、欧盟或日本均获准上市,但在WHO的儿童基本药品目录中。
改剂型方面,大容量注射剂、小容量注射剂、注射用无菌粉针之间互改剂型的,应具有明显的临床优势。预计上述剂型属于改剂型范围的都要补做临床试验,做不出临床优势的产品面临批文保不住的风险。
改盐基注射剂系指注射剂中活性成分的盐基与参比制剂不一致的注射剂,包括改变已知盐类活性成分的酸根、碱基或金属离子,对游离形式药品成盐或把成盐药品改为游离形式等。改盐基注射剂需要具有明显的临床优势。
药学研究均要求与被改盐基药品对照,进行对比试验,并对改盐基药品与被改盐基药品在各项目的异同与优劣进行评价。改盐基注射剂应与被改盐基注射剂的参比制剂质量相当。未在美国、欧盟或日本上市的改盐基注射剂产品被淘汰的几率非常大。
八、生产过程加活性炭的企业要重新改工艺了
征求意见稿要求注射剂生产中不建议使用活性炭。为了有效去除热原(细菌内毒素),需加强对原辅包、生产设备等的控制。这意味着生产工艺有活性炭的所有化学药仿制药注射剂全部都要改工艺了。
总结
从项目时间和成本来看,不用进行临床试验的化学药注射剂一致性评价项目的成本基本为药学研究成本加商业生产的成本,远远低于口服药的项目成本,预计对批文洗牌相对有限。
政策主要利好注射剂已出口国外的国产注射剂厂家。这些厂家最快拿到一致性评价并获得价格优势抢占市场。对应产品的竞争对手厂家未必能在3年内完成一致性评价,从而面临批文不保的危机。
关键词:
|