泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2017-10-20 转至微博:
|
医药网10月18日讯 作为近年来最重要的供给侧改革政策,一致性评价工作的有效推进,将在各方参与主体,包括原研/仿制企业、药品审评审批及监管相关部门、药品使用者之间产生正和博弈或至少是零和博弈,具有深远的社会意义。
目前政策要求仿制药一致性评价品种为化学新注册分类实施之前批准上市的仿制药(包括国产仿制药、进口仿制药、原研药品地产化)。强制实施品种为2007年9月1日之前批准的基药目录里的化学仿制口服固体制剂,共289个品种,需在2018年底完成;其余品种自首家通过一致性评价之后,其他同品种原则上3年内完成,未完成不予以注册。实施关键环节包括“参比制剂备案(选择国家目录)-处方工艺二次开发(药学研究)-BE备案-BE试验-现场考核(省局)-药检所复核-一致性评价申报-CFDA审批”,目前来看,完成一致性评价工作整个流程大约需要20~28个月。
“289品种”评价进度摸底调研
“289品种”被要求于2018年底完成一致性评价工作。为保证评价工作顺利完成,CFDA组织各省局对企业开展289目录内仿制药质量和疗效一致性评价的进展情况进行了摸底调研,并在国家层面以及部分省市层面公布了摸底情况。
国家层面
2017年8月21日,CFDA发布《关于企业开展289目录内仿制药质量和疗效一致性评价基本情况信息》,对截至2017年5月23日全国药企289品种“不放弃、放弃、待定、开展”情况作了汇总报告。289品种整体不放弃评价率约57%,但开展评价率仅26%,预计仍有部分企业迫于时间原因不得不放弃。从具体品种数据可以看出,部分生产企业数量少且市场空间广阔的品种,企业基本都不放弃评价,如硫酸氢氯吡格雷、阿卡波糖片、格列美脲片等。部分生产企业较多的品种,不放弃评价的企业约一半。暂未开展一致性评价的品种,多为CFDA未公布相关参比制剂目录的品种,如甲硝唑胶囊、硫酸亚铁缓释片、盐酸布桂嗪片。
地方实践
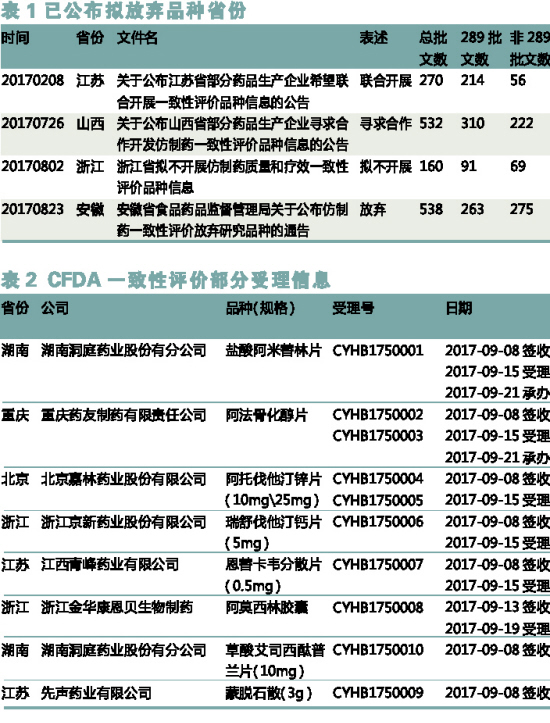
2017年8月2日,浙江省食品药品监督管理局公布该省制药企业上报的160个拟不开展仿制药质量和疗效一致性评价的品种的相关信息。这是全国范围内首次明确提出“拟放弃品种”。拟放弃品种出现最多的依次是头孢氨苄胶囊、诺氟沙星胶囊、盐酸雷尼替丁胶囊。
2017年8月23日,安徽省食品药品监督管理局公布538个选择放弃研究的一致性评价品种,其中约91%的放弃品种为企业2013年起不在产的品种。剩余48个品种多为一致性评价竞争激烈、市场空间有限品种。典型代表有诺氟沙星胶囊、头孢氨苄胶囊、对乙酰氨基酚片等。
目前大部分企业一致性评价工作仍处于参比制剂备案或药学评价阶段,但考虑到从BE备案到最终通过一致性评价约需13个月,预计2017年末“289品种”将成为BE备案及试验开展的高峰期。截至2017年9月14日,部分抢占先机的企业已进入一致性评价申报阶段。
一致性评价申请受理启动
CDE官网首次出现CYHB175开头的受理号,意味着仿制药一致性评价申报工作正式步入正轨,开始了国家局的统一受理。可以预测随后CYHB174开头的受理号也会陆续出现,这两类受理号分别代表处方工艺有变更的和处方工艺未变更的注册申请。标志着仿制药一致性评价工作进展正式进入公开公示阶段,迈出了一大步。
99个品种BE备案
截至2017年9月21日,BE备案平台共备案99个品种,共173个品规,涉及生产企业27家。其中重复备案最多的品种包括苯磺酸氨氯地平片(11家)、阿莫西林胶囊(8家)、头孢呋辛酯(6家)。其中“289品种”有42个,88个品规。
八批参比制剂目录公布
截至9月24日,仿制药参比制剂备案5820个,已发布8批参比制剂目录共计610个。对于2018年底需完成评价的“289品种”,目前仅剩4个品种没有公布参比制剂。
面临的主要问题
1.有因核查如何开展
目前已通过省局申报的7个品种完成了研制现场检查及生产现场检查,并抽样。从国家局申报的后续品种尚未进行研制情况的核查。后续问题涉及保持核查的一致性。建议明确并公开有因核查的因素和标准,以及明确有因核查的豁免条件。
2.复核检验要求尚未明确
化学仿制药口服固体制剂一致性评价复核检验技术指南仅有征求意见稿,正式稿尚未出台,指定的法定药检所或第三方检验无参考依据。个别省所不配合检验。目前政策仍比较模糊,可自行检验复核、也可法定药检所或第三方检验,标准不统一。
3.参比制剂尚未全部公布
尚有部分品种未公布确定的参比制剂,企业不敢贸然进行一致性评价。
4.信息公开不彻底
按照政策要求,进行仿制药一致性评价的品种在启动BE之前应完成临床试验信息平台的登记,但很多企业未登记公示,导致无法了解同品种开展情况,不利于资源的合理利用,无法评估已开展的企业数量。
关键词:
|