泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2017-12-27 转至微博:
|
医药网12月19日讯 2017年10月8日由中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称“两办36条”)带来一系列促进药品医疗器械产业结构调整和技术创新、提高产业竞争力、满足公众临床的法规出台。
12月14日,总局办公厅公开征求《关于调整药物临床试验审评审批的公告(征求意见稿)》意见,就是其中一个加快新药创制的政策。其中提到新药临床申报包括了药物警戒系统建立,这主要是针对受试者安全性风险控制,保障受试者的权益,也体现了政策的进步性。
但是另一方面,对于达到国际先进水平的新药项目及相关企业,却是迎来了难得的研发好光景。
接受境外临床试验数据:
进口新药潮
2017年,进口新药因CFDA接受境外临床试验数据而加快审评审批并获得进口批件:符合中国药品注册相关要求的境外多中心临床试验数据,可用于在中国申报注册申请。2017年前10个月进口药共批准了51个,形成了新一波的进口药浪潮。其中,丙肝药、糖尿病用药和心脑血管用药为主要治疗类别。
《关于调整药物临床试验审评审批的公告(征求意见稿)》也提出:对于技术指南明确、药物临床试验有成熟研究经验,申请人能够保障申报资料质量的,或国际同步研发的国际多中心临床试验申请,在监管体系完善的国家和地区已经获准实施临床试验的,申请人可直接提出临床试验申请,无需召开药物研发与技术审评沟通交流会议。这意味着上述临床试验在受理之日起60日内,未收到药审中心否定或质疑意见的,申请人可以按照提交的方案开展临床试验。
此外,CFDA的优先审评制度也加快了进口药的上市速度。咸达数据V3.5发现,共26个产品72个进口批件的获批与纳入优先审评品种名单有相关性,其中丙肝药是最大的获益治疗类别。
表1 纳入优先审评品种名单并且在2017年获批的进口药
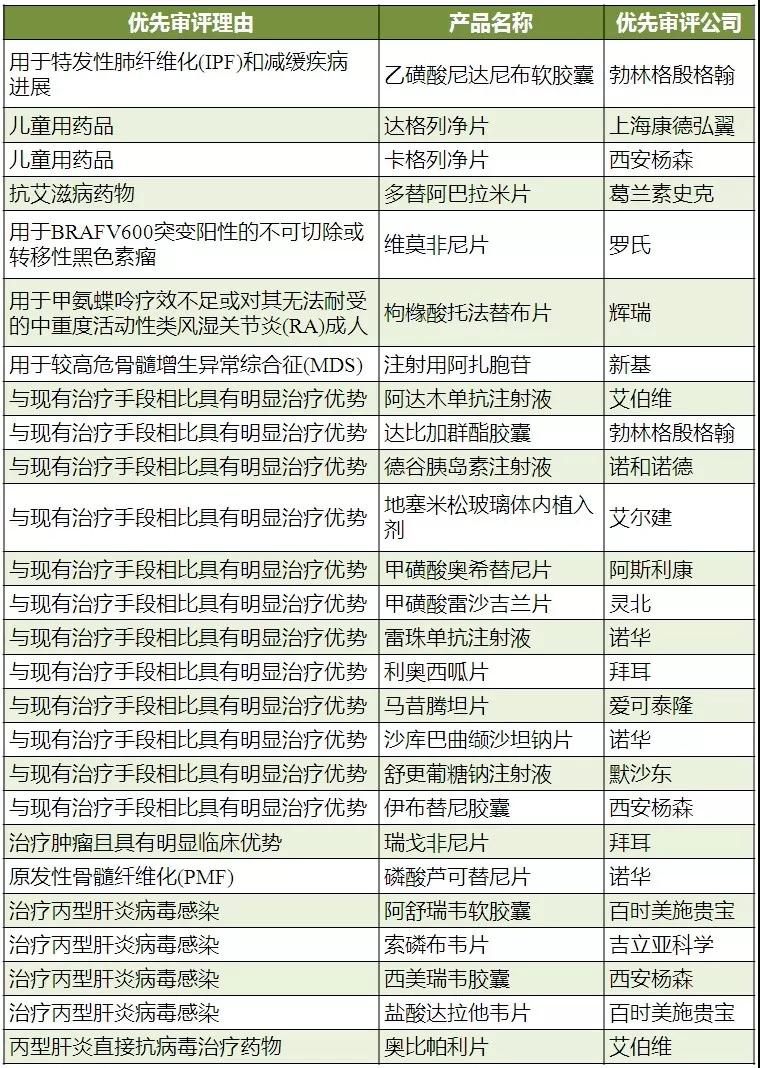 (数据来源:咸达数据V3.5)
值得注意的是,进口新药在2017年大批量上市,主要原因是长期的注册积压,以及2015年临床自查核查政策下所积累的药品数量。随着加快审评审批,进口新药的积压终会得到解决。与国际挂钩的政策方面,未来更应该关注的是国内新药同步国际化后国内企业的提升,特别是改良型新药505(b)(2)如何利用双报加快国内外新药同步上市。
明确“可附带条件批准上市”:
PD-1/L1、CAR-T抢报上市
对于“临床试验早期中期指标显著可附带条件批准上市”,“两办36条”提到,对治疗严重危及生命且尚无有效治疗手段疾病以及公共卫生方面等急需的药品,临床试验早期、中期指标显示疗效并可预测其临床价值的,可附带条件批准上市。境外已批准上市的罕见病治疗药品医疗也可有条件批准上市。
对此,《关于调整药物临床试验审评审批的公告(征求意见稿)》提到,已获准开展临床试验的,在完成Ⅰ期、Ⅱ期临床试验后、开展Ⅲ期临床试验之前,申请人应向药审中心提出沟通交流会议申请,就Ⅲ期临床试验方案设计要点与药审中心进行讨论。这也为“有条件批准上市”的生产受理提供了基础:申请人可以根据关键Ⅱ期试验结果与CFDA沟通,并寻求申报上市的可能性。
实际上,国内新药早有以罕见病治疗为由有条件批准上市的案例。西达本胺在2014年时就因为治疗外周T细胞淋巴瘤(PTCL)为罕见病,且支持注册的关键Ⅱ期试验采用单臂、多中心设计,其研究方案与国外近几年批准上市用于PTCL的三个药物注册研究设计类似,其有效性数据亦与国外同类产品报道结果相似,加上其在中国发生率高的亚型(难治的T/NK细胞淋巴瘤鼻型)上显示出更好疗效趋势(有效率18.8%),符合对该疾病预期的临床获益从而得以有条件批准上市。
2017年,国内新药厂家的个别新药在关键Ⅱ期试验完成就开始冲刺上市。如恒瑞2017年12月10日公告,已于近期完成吡咯替尼Ⅱ期临床试验。试验结果显示,吡咯替尼显著优于对照药拉帕替尼。基于目前Ⅱ期临床试验获得的疗效和安全性数据,CFDA同意受理恒瑞递交的吡咯替尼有条件上市的申请,适应症为可用于治疗 HER2 表达阳性的晚期或转移性乳腺癌。
信迪单抗注射液,研发代码为IBI308,完成Ⅱ期临床试验后就在2017年12月报产。信迪单抗是继百时美施贵宝Opdivo之后第2个申请中国上市的PD-1/PD-L1药物。
若新药研发的特有通道被打通,预计12月首家申报CAR-T 治疗的南京传奇生物科技有限公司的LCAR-B38M(即CAR-T细胞自体回输制剂)也有望国内免Ⅲ期有条件上市,最快在2019年即可上市。
综上所述,想要获得有条件上市加快新药获批,要求该药品是临床必需急需药品且临床试验的设计要与国际同步,临床试验结果必须显著且对国内人群更适用。
小结>>>
一方面,《关于调整药物临床试验审评审批的公告(征求意见稿)》发布,意味着我国进入临床试验易入难出的年代。
另一方面,中国新药研发遇到了难得的好光景,市场、政策、都是近年以来最好的时机,能不能突围,比拼的是项目技术层面的细节:如新药成药性研究、临床试验方案设计的完整性、科学性和可操作性等。项目达到国际先进水平的国内新药及相关将获益。
关键词: 药品审批
|