泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2018-04-23 转至微博:
|
医药网4月19日讯 科睿唯安发布的最新报告《最值得关注的药物预测 2018》预测了12个在2018年上市(已上市或可能上市)的重磅新药,这些新药在5年内的销售额都将达到重磅炸弹级别。
这12种药物中,超过一半获得了优先审评、突破性疗法或快速通道等审评认定,其中5个是首创型(first-inclass)新药,4个是孤儿药,抗肿瘤药仅有1个上榜,即强生的Erleada(apalutamide)。
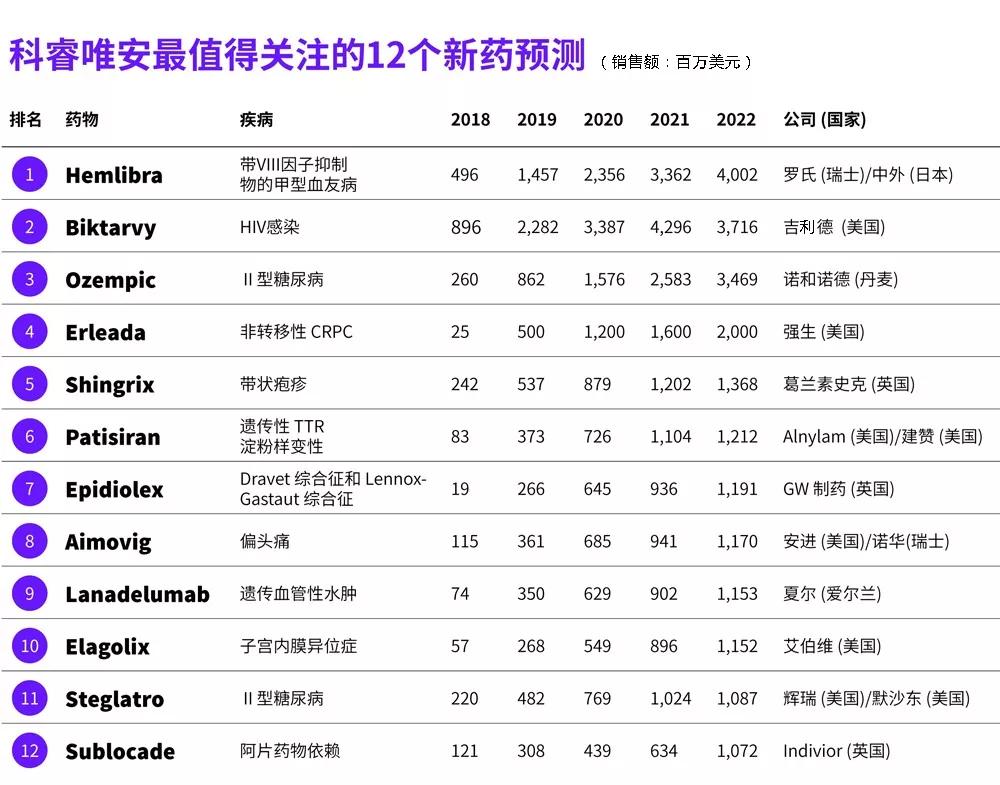 1 Hemlibra
血友病市场未来领导者
凝血因子Ⅷ抑制物的出现是血友病治疗中最严重,也是最具挑战性的并发症。Hemlibra已获批用于携带Ⅷ因子抑制物的或成人甲型血友病出血预防,以杜绝或降低出血事件的发生。该药的获批为这种疾病带来了20年来的首个新型疗法,目前该领域可用的其他药物主要是夏尔(Shire)的Feiba (凝血酶原复合物)和诺德诺德的NovoSeven(重组凝血因子Ⅶa)。
事实上,FDA对Hemlibra做出审批决定的时间期限是2018年2月,但因为优先评审、突破性疗法和孤儿药认证,FDA于2017年11月提前批准了Hemlibra。
无论如何,Hemlibra都是2018年最值得关注的新药之一,因为该产品的销售推广将在2018年全面铺开,而且还将在更多国家获批上市。2018年2月,欧洲管理局(EMA)批准了Hemlibra,该产品有望年内同时登陆欧盟和日本市场,预计2018年的销售额可达4.96亿美元,2019年将增加至14.57亿美元,2022年达40.02亿美元。
2018年之后,Feiba和NovoSeven可能因Hemlibra的竞争而销售额大幅下滑。最大的冲击是Hemlibra将获批用于不限制Ⅷ因子抑制物的甲型血友病,这将大幅度拓宽它的用药范围。
Hemlibra全新的作用机制、卓越的疗效和潜在每月1次的给药频率将对Ⅷ因子市场格局造成巨大冲击。尽管有黑框警告(FDA对潜在严重的严重警告)血栓风险,但是Hemlibra仍将引领2020年以后的血友病治疗市场。
2 Biktarvy
与GSK产品抢夺HIV市场
吉利德每日一片的HIV组合疗法Biktarvy是一种含新的整合酶抑制剂bictegravir、核苷逆转录酶抑制剂替诺福韦艾拉酚胺和恩曲他滨的复方制剂,于2018年2月中旬在美国获批并迅速上市。
吉利德与GSK在抗HIV市场上的争夺十分激烈。2014年,GSK推出了Triumeq,该产品的成功让其在抗HIV市场扳回一局。作为回应,吉利德又推出了几种安全性更好的最佳组合方案,包括2015年上市的Genvoya、2016年推出的Odefsey和Descovy,这些产品帮助吉利德重新夺回失去的市场份额。
2018年1月,GSK又上市了度鲁特韦/利匹韦林,这是一个含整合酶抑制剂Tivicay(度鲁特韦)与利匹韦林的最佳组合方案。bictegravir的安全性和有效性都与Tivicay相当,而且与Tivicay一样,是真正的每日1次整合酶抑制剂,无需额外添加任何增强剂。
随着替诺福韦酯的仿制药在2017年12月上市,Atripla和Truvada的仿制药也有望在近期上市,而且GSK基于Tivicay疗法的市场份额还在不断增加,吉利德极有可能开足马力推广Biktarvy。
预计Biktarvy在2018年销售额将达8.96亿美元,2019年会快速上涨至22.82亿美元,2022年将升至37.16亿美元。
3 Ozempic
竞争力待充分挖掘
诺和诺德每周1次给药的GLP-1类似物Ozempic(索马鲁肽)于2017年12月获批用于治疗2型糖尿病,2018年2月上市。
每日1次给药的诺和力(利拉鲁肽)的市场份额正在逐渐丧失,而每周1次给药的GLP-1类似物的市场份额正在逐渐增加,尤其是礼来的Trulicity(度拉糖肽)。不过,2017年公开的SUSTAIN 7的数据显示,Ozempic的降糖效果与减重效果优于Trulicity。
收集Trulicity心血管获益证据的临床试验REWIND还在开展中,数据有望在2018年公开。因为Ozempic已经获得积极的心血管效益证据,它将力压Trulicity,助力诺和诺德抢回GLP-1市场份额。尽管如此,Trulicity仍将成为2022年GLP-1市场的领头羊,预测销售额为40.09亿美元,诺和力为39.12亿美元,而Ozempic为34.69亿美元。
注射给药的GLP-1类似物通常在口服降糖药无法控制血糖的条件下使用,然而每日1次的口服索马鲁肽(PIONEER项目评估中)将改变2型糖尿病治疗的“游戏规则”。口服GLP-1可在更早的治疗阶段接替小分子降糖药,这种方案不但能更有效降糖,而且还能使心血管获益。此外,索马鲁肽还在开展肥胖症的临床研究和非酒精性脂肪肝(NASH)临床的研究,将全方位地对竞争产品构成威胁。
4 Erleada
先发优势驱动销售增长
去势抵抗前列腺癌(CRPC)市场由强生的新一代口服抗雄性激素药Zytiga(阿比特龙)和安斯泰来/辉瑞的Xtandi(恩扎鲁胺)主导,然而这两个产品都只获批用于转移性的CRPC。2018年2月中旬获批的第二代抗雄性激素新药Erleada(强生研发)抢得了先机,成为非转移性CRPC领域的首个疗法。
Xtandi在针对非转移性CRPC的临床试验(PROSPER)中已表现出积极数据,已经向FDA提交了这一适应症的上市申请。尽管如此,Erleada有先发性优势,该产品在获批不久后就进入了美国市场,预计其销售额将在2020年达到重磅炸弹级别。
除了非转移性CRPC,Erleada还有潜力获批其他适应症,包括转移性激素敏感的前列腺癌(TITAN试验)、局部高危/局部晚期前列腺癌(ATLAS试验)以及联合阿比特龙治疗未经化疗的转移性CRPC,这些都将成为其销售额高速增长的驱动力。
5 Shingrix
两年或可赶超竞品
在2017年10月获得FDA批准之后,GSK的Shingrix(重组带状疱疹疫苗,佐剂)将在2018年初投放市场。其是十多年来第一个新型带状疱疹疫苗,默沙东的Zostavax是此前FDA唯一批准的带状疱疹疫苗。
Zostavax的预防效果会随时间的推移而逐渐下降,而Shingrix能持续提供保护,而且其对Zostavax预防失效人群仍然有效。尽管Zostavax只需一剂,而Shingrix需要两剂,但美国疾病控制和预防中心已在2018年1月正式推荐使用Shingrix对50岁以上人群进行接种。
上市两年内,Shingrix有望取代Zostavax成为带状疱疹疫苗市场的引领者,预计Shingrix在2019年的销售额可达5.37亿美元,而Zostavax销售额将从2014年的7.65亿美元(峰值)下降至4.92亿美元。此外,Shingrix的销售额将在2021年后超过10亿美元。
6 Patisiran
有望成美国首个RNAi药物
Patisiran申请的适应症为遗传性转甲状腺素蛋白相关的淀粉样变性,如果成功获批,其将成为美国首个RNA干扰药物(RNAi)。此前FDA已经授予patisiran优先审评、快速通道和突破性疗法认定,PDUFA期限是2018年8月。欧洲方面,EMA已经授予了patisiran加速审评资格。该产品有望在2018年底同时登陆美国和欧洲,成为遗传性转甲状腺素蛋白相关淀粉样变性的疗法。
目前针对该疾病的标准疗法是肝脏移植,但这种疗法存在手术风险,急性肝排斥反应、感染风险,对临床条件要求较高,而且只可对能接受干预的患者治疗。
辉瑞的Vyndaqel(tafamidis)是首个抗淀粉样变性的药物,但目前仅获批用于家族性淀粉样多发性神经病,不仅如此,该产品仅限于疾病早期使用,而且美国尚未获批上市。
7 Epidiolex
打造大麻提取物医用模板
GW制药的Epidiolex(植物提取的大麻二酚)有望成为首个含大麻二酚的抗癫痫药,FDA已经授予其优先审评资格,PDUFA期限为2018年6月。
此外,欧洲的上市申请(MAA)也已提交。因为Epidiolex对Dravet综合征与Lennox-Gastaut的疗效数据都非常有说服力,所以获批的概率很大。
虽然Epidiolex可能获批上市,但在销售上仍存在政策上的障碍。这道障碍限制了所有大麻提取药物的应用,尤其是美国,有严格的指南约束大麻药物的使用。
尽管如此,到2022年,Epidiolex的年销售额有望达11.91亿美元。Epidiolex非常值得期待,其可以为大麻提取物的医疗使用铺平道路。
8 Aimovig
上市速度最关键
Aimovig(erenumab)有可能成为首个上市的 CGRP抑制剂。获得首个上市权对于Aimovig而言至关重要,因为来自同靶点两个单抗药物的竞争即将来临。礼来的galcanezumab(每月1次)和梯瓦的fremanezumab(每月1次或每3月1次)均已向FDA提交了上市申请。Alder公司的eptinezumab(每3月1次)还在进行Ⅲ期临床试验,但是在某些患者中应答率高达100% ,该产品有望在2018年提交上市申请。
Aimovig有望成为CGRP抑制剂市场的“领头羊”,2022年的预测销售额为11.70亿美元;fremanezumab凭借3月1针的优势位列第二,预测销售额为9.99亿美元;galcanezumab排在第三位,预测销售额为5.46亿美元;其后为eptinezumab,预测销售额为3.68亿美元。因为强大的临床数据,eptinezumab的销售额将高速上涨,2023年有望达9.46亿美元。
值得注意的是,未来还将出现口服CGRP抑制剂的竞争,如艾尔建的atogepant和Biohaven公司的rimegepant,因为口服的优势,这些产品将从市场分走很大一杯羹。
9 Lanadelumab
多竞争优势助力销售
夏尔的新型遗传性血管水肿药物lanadelumab的上市申请已提交,而且分别获得美国的优先审评和欧盟的加速审评资格。
夏尔的Cinryze(人补体C1酯酶抑制剂)是当前预防血管性水肿发生的主要产品,但最主要缺点是需要静脉注射给药。首个皮下给药的产品是CLS贝林在2017年获批上市的补体C1酯酶抑制剂Haegarda,尽管该药存在先发优势,但是lanadelumab仍将主宰遗传性血管水肿的一线预防市场,而且因为疗效优越和给药方便,用药量必将大幅增长。
尽管Haegarda和Cinryze也都是两周1次的疗法,但是lanadelumab在两周1次给药的基础上有望实现每月1次给药。与此同时,Lanadelumab的注射药量比Haegarda少,注射所需要的时间也更少,这些特性都将赋予它竞争优势以获得巨大的销售收入。
预计Cinryze 在2018年的销售额为6.65亿美元,但是2022年将下降至2.83亿美元,而lanadelumab的销售额将从2018年0.74亿美元增加到2022年的11.53亿美元。
10 Elagolix
填补空白市场
艾伯维的Elagolix已向美国FDA提交了疼痛性子宫内膜异位症的上市申请,FDA授予了该药优先审评资格。不过,4月10日艾伯维宣布收到通知,FDA要求延长审评时间,以充分评估Elagolix上市申请资料中药物对患者肝功能影响的数据,PDUFA预定审批期限将延长至今年第3季度。
子宫内膜异位症是一种无法治愈的疾病,只能对症治疗而且是终身控制治疗,常见的治疗方案包括口服避孕药、孕激素、达那唑、阿片类药物和促性腺激素释放激素(GnRH)激动剂(Lupron、艾伯维的亮丙瑞林注射微球)等。这些疗法很多都属于超说明书用药,给药不方便且有很多不良反应,如体重增加、骨质流失和更年期样副作用。
Elagolix是一种首创性的口服GnRH拮抗剂,因为全球有1.7亿受子宫内膜异位症影响,因此即便是轻微的市场渗透也能带来巨大的销售额。但在未来几年,Elagolix将面临Myovant公司relugolix的竞争, 这是一个处于Ⅲ期临床开发阶段的口服GnRH拮抗剂,而且有望在2024年达到重磅炸弹级别。
11 Steglatro
SGLT-2抑制剂市场突围
SGLT-2抑制剂Steglatro(ertugliflozin)的直接竞争对手包括强生的Invokana (卡格列净,2013年上市)、阿斯利康的Farxiga(达格列净,2014初上市)和勃林格殷格翰的Jardiance(恩格列净,2014年末上市)。
Steglatro存在独特的优势,这有助于它在激烈的竞争中抢夺市场份额。单独用、与二甲双胍联合用药、与西格列汀联合用药的临床试验都证明了Steglatro的有效性,而且在所有临床试验中Steglatro都表现出可显著降低体重和血压。这促使FDA在2017年同时批准Steglatro单药治疗、联合西格列汀治疗(Steglujan)和联合二甲双胍治疗(Seglurome)。
收集Steglatro心血管获益证据的临床研究(VERTIS CV)还在进行中,结果有望在2019年公开,Steglatro积极的心血管获益数据将是巩固其在SLGT-2抑制剂中地位的关键。
2016年,Invokana是SGLT-2抑制剂中唯一的重磅炸弹,销售额为14.07亿美元。心血管获益,以及其他方面的优势将有助于这类药物的销售额高速攀升。到2022年,Farxiga有望成为SGLT-2抑制剂市场的“领头羊”(预测销售额20.25亿美元),Jardiance将坐上第二把交椅(预测销售额17.13亿美元),Lexicon/赛诺菲的SGLT-1/2双重抑制剂sotagliflozin将名列第三(预测销售额为11.93亿美元)。sotagliflozin有可能在2018年上半年提交上市申请,有望在2019年进入市场。之后将是Steglatro和Invokana,2022年预测销售额分别为10.87亿美元和6.52亿美元。Invokana因在CANVAS试验中观察到有截肢风险而被加上黑框警告,这将导致其销售额发生下滑。
12 Sublocade
弥补当前疗法缺陷
Indivior公司的Sublocade (每月一次丁丙诺啡注射剂)于2017年11月获得FDA批准,这是首个每月一次的丁丙诺啡处方。
药物辅助脱瘾治疗市场将会因Sublocade在2018年3月的上市而发生翻天覆地的变化。当前药物辅助脱瘾治疗产品存在诸多局限性,比如每日1次口服疗法的治疗负担和患者依从性问题,植入剂的手术条件限制和与之带来的手术风险问题,Vivitrol有脱瘾期的限制的问题,而这些问题正好给新型疗法留下了市场空间。
Sublocade只需每月1次在医疗机构接受皮下注射,无脱瘾期要求,当前疗法存在的诸多问题得到了很好的解决。
考虑到美国严重的阿片药物滥用危机,Sublocade的销售额有望达到重磅炸弹级别,2022年的预测销售额为10.72亿美元。
关键词:
|