泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2017-09-30 转至微博:
|
医药网9月15日讯 进入9月,中药注射剂的日子开始不好过了!
被严格限制
2017年2月,人社部公布了新版《国家基本医疗保险、工伤保险和生育保险药品目录(2017年版)》(以下简称《药品目录》),其中,有49个中药注射剂品种入选,然而,此次《药品目录》对于中药注射剂使用进行了严格的受限,受限品种达到39个,在受限品种中,包括双黄连注射液、清开灵注射液、疏血通注射液等多个品种限二级以上医疗机构使用,并做了重症、病种的限制,该限制意味着基层若使用将不予以医保报销。
9月1日开始,2017年新版药品目录在多个省份正式实施,这也意味着中药注射剂将受到多重限制。
无独有偶,前几日,一份社保局发给乡镇卫生院的《限二级以上医院用药品种目录》(以下简称目录)在业界流传,该目录显示:自9月1日起,包栝血栓通、血塞通、清开灵、双黄连、丹参等基层常用的27种中药注射剂,在乡镇卫生院使用不予报销,据悉,这份《目录》的来源是河南省。
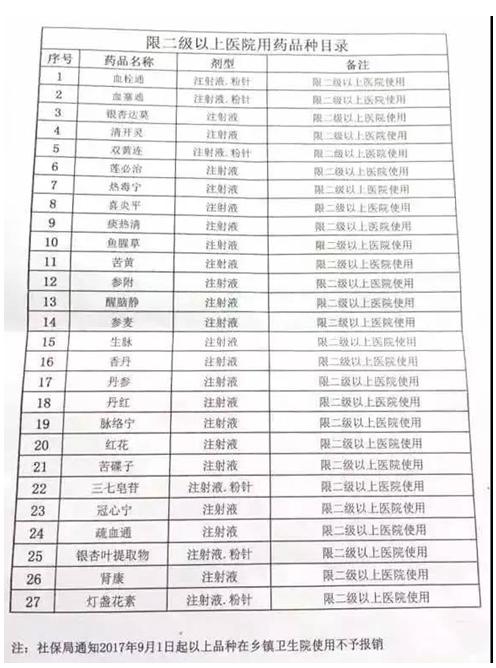 有行业人士对此分析,这份名单或不单单适用于河南省,而是放之于全国,即从9月份开始,村卫生室、社区卫生中心、乡镇卫生院等二级以下的医疗机构将不能再使用以上20余种中药注射剂,除非自费,此外,该类药品受限后,采购也或将是一个问题。
多家上市公司将受影响
一位资深行业人士指出,本来经过2009年、2012年的培育,基药中药注射剂成为快品种、大品种。而此次医保目录的调整,以及各省的控费,都将使得中药注射剂雪上加霜,《国家基本药物目录》中的中药注射剂将受到最大的冲击。
因此,多家上市公司包括中恒集团、昆药集团、益佰制药等也于日前相继发布公告,内容均涉及自家的受限制使用注射剂产品。
中恒集团发布《关于子公司产品注射用血栓通(冻干)医保基层报销受限影响的补充公告》称,注射用血栓通(冻干)属于公司的主打产品,该产品在2016年度的销售收入13.83 亿元,占公司营业收入82.81%,二级以下医疗机构销售占比30%;2017年上半年,注射用血栓通(冻干)销售收入8.05亿元,占公司营业收入86.19%,二级以下医疗机构销售占比29.8%。
 公告称,由于目前很多省份已开始陆续执行新版医保目录,对注射用血栓通(冻干)在河南以及其他省区的销售影响仍需要进一步评估,以河南省为例,注射用血栓通(冻干)2016年在该省全省的销售额0.8亿元,基层占比约30%,政策实施后,预期影响比例5%-15%。
对于受限影响,中恒集团称公司正积极采取应对措施,将继续通过严控、加大学术推广力度、加强营销管理、精细化管理、增强研发力度,并增加研发及营销团队人员,全力做好市场开发、降本增效工作,确保公司产品在核心领域的市场优势地位。
昆药集团发布《关于血塞通注射剂产品新版医保目录执行的说明公告》表示,根据产品流向数据统计,2016年全年至2017年上半年,公司血塞通注射剂(注射液、粉针)在二级以下医院(不含二级医院,以下简称“基层医院”)的销售占比约为45-50%,2016年,血塞通的工业销售收入达6.6亿元,二级以下医院销售占比47%,2017年上半年该销售额4000万元,基层医院占比46%。随着新版国家医保目录在各省市相继落地,血塞通注射剂(注射液、粉针)在各省市基层医院使用时医保支付将受到限制,对该部分医院市场销售将受到一定的影响。
 昆药集团称,假设全国市场均按照2017年9月1日开始执行国家新版医保目录,两个品种所受影响度为公司2017年全年工业销售收入减少约10-15%,全年净利润的减少约5-10%。
对于该影响,昆药集团方面表示,产品虽受国家新版医保目录限等级医院使用,但并未限制按适应症使用,公司将在其他竞品限制适应症产品市场中,加临床研究、学术推广活动,增加非受限市场的产品销售业绩。
益佰制药发布公告表示,与2009版医保目录相比,公司的银杏达莫注射液在新版医保目录受增加适应症限制,具体为“限二级及以上医疗机构并有明确的缺血性心脑血管疾病急性期患者”。2016年,银杏达莫注射液实现销售收入4.2亿元,营业收入占比11.44%,毛利占比为13.10%;2017年上半年,实现销售收入约2亿元,营业收入占比为9.95%,同比增长12.33%,毛利占比为11.69%。该产品销售终端结构是,二级以下 (不含二级)医院市场占比为20%左右。据了解,在这一市场中,益佰制药的市场份额最大。
 益佰制药董秘李刚表示:“损失肯定会有,但是从目前来看还没有产生实质性损失。从9月1号开始实施新的医保,反映在医生的用药习惯上,还有一个过程,所以预估对今年的销售应该不会有太大影响”。
为何被限
一直以来,关于中药注射剂的安全性与有效性的问题屡被提及,也是阻碍其发展的“最大绊脚石”。
2015年国家药品监测年度报告显示,2015年全国药品不良反应监测网络共收到中药注射剂报告12.7万例次,其中严重报告9,798例次(7.7%),2015年中药不良反应/事件报告中,注射剂占比例为51.3%。
2016年国家药品不良反应监测年度报告显示,2016年中药不良反应/事件报告中,注射剂所占比例高达53.7%。报告还指出,从涉及剂型与给药途径看,中药注射剂占比较高,需要继续关注其安全用药风险,从药品类别上看,主要涉及活血化瘀类、清热解毒类、益气养阴类、凉开类中药注射剂,提示应继续关注上述类别药品用药风险,及时采取风险控制措施。
据了解,中药注射剂得不良反应主要涉及全身性损害、呼吸系统损害、皮肤及其附件损害等,包括过敏样反应、过敏性休克、寒战、发热、呼吸困难、胸闷、心悸、瘙痒、皮疹、恶心、呕吐等表现。
在今年6月召开的第十二届全国人民代表大会常务委员会第二十八次会议上,国家食品药品监督管理总局局长毕井泉在《国务院关于药品管理工作情况的报告》中就曾指出,药品质量安全风险隐患较多。注射剂特别是早期批准上市的以中药为原料生产的注射液,安全性、有效性基础研究薄弱。部分生产偷工减料、使用假劣原料、擅自改变生产工艺,严重影响药品的安全性、有效性。毕井泉对此表示,对此,下一步的重点工作将”分期分批推进已上市注射剂有效性、安全性评价。
其实,早在8年之前,我国就启动过一轮中药注射剂再评价工作。2009年7月16日,国家食品药品监督管理局发布《关于做好中药注射剂安全性再评价工作的通知》等一系列文件,全面启动中药注射剂再评价工作,但有行业观察员指出,直到现在为止,该再评价工作并没有真正落地。究其原因,有医疗界人士指出,一方面在于药企不怎么愿意开展中药注射剂再评价工作,另一方面是顶层设计没有明确再评价工作相关细则。
不过,据有行业人士预判,在2018年前后,国家可能会对中成药开展类似的“疗效、安全和风险”评价来真的,并以“上市后再评价”的方式进行,到时中成药企业将会迎来一次大洗牌,而中药注射剂作为中成药处方药里的最大的剂型,受到的波及影响会无可避免。
关键词:
|